 |
 |
|
專題報導 |
轉換期牛隻免疫系統變化
|
前 言 |
|
|
牛隻在轉換期面對相當嚴苛的考驗。各種原因所造成的緊迫使得轉換期牛隻的代謝性疾病和感染性疾病發生率顯著提高,嚴重程度也加劇。大部分酪農朋友都曾經被轉換期牛隻的代謝疾病所困擾,也深深的為牛隻分娩前後的感染性疾病(例如:乳房炎、子宮炎?等)所苦。代謝疾病主要是因為分娩前後的生理變化與營養代謝失衡所造成的,而免疫系統機能在這段期間受到抑制則是感染性疾病好發的主因;事實上,代謝性疾病和感染性疾病也經常互為因果關係。 |
|
|
牛隻的免疫系統在轉換期受到抑制是明顯的事實(Kehrli et al., 1989a,b),當然這也成為轉換期學術研究的主要方向之ㄧ,但是因為免疫系統非常複雜,這方面研究的進展也較營養代謝方面緩慢。本文的主要目的在探討轉換期牛隻免疫系統的變化,以及造成免疫系統機能在這段期間受抑制的原因。我們深信只有透過對現有研究文獻審慎的整合分析才能為轉換期的感染性疾病的防治找到ㄧ線曙光。 |
|
|
牛隻免疫系統概述 |
|
|
免疫系統的組成和作用機制非常複雜,在此我們僅做概要性的陳述(本段內容主要參照Immunology, Roitt et al., 6th edition),讀者如果需要更深入牛隻免疫系統的詳盡資訊請參閱Pappe et. al., (2003),Sordillo & Streicher (2002),和Sordillo et. al., (1997)。動物的任何免疫反應都包含兩個動作,首先,免疫系統需要先辨識病源或外來物質,然後再藉由特定的機制將其摧毀或消除。免疫反應可以廣義的分成兩類:先天性(innate or non-adaptive)免疫反應和後天適應性(adaptive)免疫反應;這兩種免疫反應最大的差異在於適應性免疫反應對特定的病源有高度的專一性,而且適應性免疫反應會隨著同一病源的重覆感染而增強,也就是說適應性免疫反應可以「記憶」特定感染源,在往後同一病源感染時可以預防或緩和疾病的發生。具有多種不同型態的白血球(leucocytes)是產生免疫反應的主要來源。 |
|
|
免疫系統主要由免疫細胞(cells)和可溶性調控因子(soluble mediators)所組成,可溶性調控因子是由免疫細胞分泌至體液中,用來調控或傳遞訊息的物質。免疫細胞包括:吞噬細胞(phagocytes)、淋巴細胞(lymphocytes)、輔助細胞(auxiliary cells);可溶性調控因子則包括:抗體(antibodies)、細胞激素(cytokines)、補體(complements)。由免疫細胞所產生的免疫反應稱為細胞免疫反應(cell-mediated immunity);由體液中可溶性調控因子所產生的反應則稱為體液免疫反應(humoral immune response)。 |
|
|
免疫白血球中很重要的一個族群是吞噬細胞,這個族群包括:單核吞噬細胞(mononuclear phagocytes)、巨噬細胞(macrophage)、多型態核嗜中性白血球(polymorphonuclear neutrophils, PMN),這些細胞以最原始、非專一性的辨識系統來辨認外來的感染源,然後將這些外來的微生物吞噬進入體內並且加以殺害。吞噬細胞是先天免疫反應的主要來源,由於它們的作用機制並沒有專一性和特定性,所以對所有的微生物都有作用;事實上,吞噬細胞是對抗外來感染源的第一道防線。 |
|
|
免疫白血球另外一個很重要的族群是淋巴細胞。淋巴細胞是所有適應性免疫反應的主軸,因為不論病源是在宿主細胞內或在血液及其它體液中游移,淋巴細胞都可以專一的辨識特定的病源。淋巴細胞主要分成T-細胞和B-細胞兩類。B-細胞的作用是產生抗體來對抗細胞外的病源和病源所產生的物質;病源表面的某些分子或病源所產生毒素稱為抗原(antigen),B-細胞所產生的抗體可以專一的辨視並且抓住特定的抗原。T-細胞的作用較為廣泛,某些T-細胞會參與B-細胞發育與產生抗體的控制,另ㄧ群的T-細胞可以協助吞噬細胞將吞噬進來的病源體摧毀,還有一組T-細胞能夠辨識被病毒感染的細胞並且加以破壞。根據抗原標識的存在與否,T-細胞又分為αβ-和γδ-T-細胞兩種,反芻動物血液中的γδ-T-細胞比例明顯的比非反芻動物高,想必它在牛隻的免疫機能上有特殊的作用,這個問題亟待進一步的研究來證明(Kimura, et al., 1999b)。 |
|
|
事實上,吞噬細胞和淋巴細胞之間有許多的交互作用。某些吞噬細胞會吞噬抗原,並且把抗原以T-細胞可以辨識的形式呈現給T-細胞,此舉可以刺激T-細胞的功能,稱之為抗原呈獻作用(antigen presentation);相對的,T-細胞會釋出細胞激素(cytokines),這些可溶性調控因子可以活化吞噬細胞殺害病源體的能力。另ㄧ類的交互作用是B-細胞所產生的抗體可以協助吞噬細胞更有效率的辨識病源體。因為吞噬細胞和淋巴細胞有這些交互作用,因此動物在面對傳染性病源時的免疫反應大都會有先天免疫和適應性免疫作用同時參與。通常在感染的初期,先天免疫反應會扮演主要的角色;隨後,淋巴細胞再逐漸產生適應性免疫反應,並且「記憶」此一病源;當同一病源在往後重複感染時,動物體就可以產生比較快速有效的免疫反應。 |
|
|
免疫系統中輔助細胞透過發炎調控因子來調控發炎反應,發炎反應的主要目的是要吸引白血球和可溶性調控因子進入受感染的部位。此外,可溶性調控因子中的補體也扮演控制發炎反應的角色。補體在免疫系統中也有多樣化的功能,例如:調理(opsonization)微生物細胞以促進吞噬細胞的吞噬作用、吸引吞噬細胞到受感染位置、分解細菌和病毒、增加感染位置的血流量和微血管通透性。 |
|
|
以乳房的免疫系統為例,血液中嗜中性白血球要迅速有效的抑制外來感染源就必須具備下述完整的機能(Burton, et al., 2001)。首先,要有足夠數量的嗜中性白血球在血管壁游移,隨時監控乳腺的感染和發炎狀況,這時嗜中性白血球藉由細胞表面的一種蛋白質L-選擇素(L-selectin)和血管內表皮形成鬆散的鍵結,持續的在血管內壁滾動(Kimura, et al., 1999a);這些嗜中性白血球必須有能力迅速的穿過血管壁到達受感染位置,此時嗜中白血球表面的另一種蛋白質β2-整合素(β2-integrins)增加,延長嗜中性白血球在定點的停留時間(Kimura, et al., 1999a)來通過血管壁;然後,嗜中性白血球要儘快與外來感染源有實質的物理性接觸,讓吞噬作用產生;當細菌被噬入吞噬囊(Phagosomal vesicles)後,嗜中性白血球迅速的活化呼吸爆發(respiration burst)代謝,產生高活性的氧和過氧化氫來殺死細菌;最後,吞噬囊必須與同在嗜中性白血球內的分解囊(lysosomal vesicels)結合,利用分解囊中的分解酵素將細菌完全的解體。但是嗜中性白血球在殺害病源的過程也可能受到不同程度的傷害,例如:呼吸爆發代謝所產生的活性氧和過氧化氫雖然能夠殺死細菌但是也會傷害嗜中性白血球的細胞膜,造成嗜中性白血球的機能下降或死亡;因此,某些抗氧化物(antioxidants如:維生素E、β-葫蘿蔔素、以硒為主要成分的glutathione peroxidase)就有保護和修補嗜中性白血球細胞膜的功能。當入侵的外來病源數量和攻擊能力大於免疫系統的防禦能力時,動物體就會出現臨床症狀。 |
|
|
轉換期牛隻免疫系統的變化 |
|
|
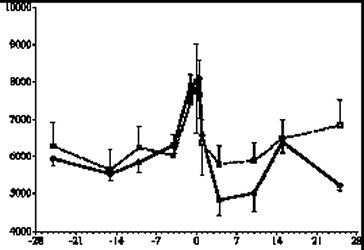
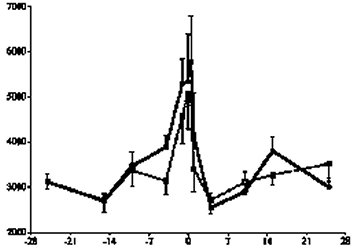
牛隻的免疫系統在轉換期有顯著的變化是不爭的事實,許多文獻都提供了充分的科學證據。研究發現牛隻在接近分娩時體內的白血球總數顯著增加,嗜中性白血球數量的激增是造成此一現象的主因(Kimura et al., 1999a)(【圖一】)。雖然數量顯著增加,但是嗜中性白血球的機能在轉換期卻明顯的受到傷害。嗜中性白血球是否迅速大量的由血管移動進入受感染位置是免疫反應的第ㄧ個關鍵步驟;在轉換期,牛隻的嗜中性白血球迅速移動進入周圍組織的能力明顯的降低(Kimura et al., 1999a),造成受感染位置的嗜中性白血球數量不足。有部分研究顯示轉換期牛隻嗜中性白血球的吞噬能力有明顯的提升(Burton et al., 2001),但是對外來病源的殺傷能力卻明顯的下降(Kehrli, 2001, Mallard, et al., 1998)。Mehrzad et al., (2002) 証實轉換期牛隻的嗜中性白血球產生較少的活性氧化合物(reactive oxygen species, ROS),亦即呼吸爆發(respiration burst)代謝顯著減弱;而嗜中性白血球的呼吸爆發代謝活性與與乳房炎的感染率和感染後的嚴重程度呈現負相關(Heyneman et al., 1990; Zecconi, et al., 1994)。Kimura et al., (1999a)以嗜中性白血球內分解囊所含的一種分解酵素myeloperoxidase 作為嗜中性白血球殺菌能力的指標,結果發現這個酵素的活性在分娩前顯著的下降(【圖二】),但是乳房切除牛隻在產後恢復比較快。這些科學證據為先天免疫系統在轉換期的變化提供了最好的註解。 |
|
 |
 |
|
(圖例說明:實線為一般正常牛,虛線為乳房切除牛;左圖的X軸為距離分娩的天數,Y軸為每立方毫米血液之總白血球數; |
|
|
(圖例說明:實線為一般正常牛,虛線為乳房切除 |
淋巴細胞在轉換期所發生的功能缺陷也是免疫系統機能下降的主因(Kehrli, 2001)。淋巴細胞在這段期間主要的變化包括:細胞激素的組成改變和抗體產量的減少。牛隻在分娩之前幾天淋巴球的數量降到谷底主要是因為CD4+,CD8+和γδ這幾種 T-淋巴細胞數目減少所致,因為在同一時段B-淋巴細胞的比例保持穩定(Shafer-Weaver et al., 1996)甚至稍有增加(Van Kampen & Mallard, 1997);但是B-淋巴細胞產生某種抗體(免疫球蛋白M)的能力卻明顯的下降(Stabel, et al., 1991; Detilleux et al., 1995)。一般認為雌性動物在懷孕之後細胞免疫(cell mediated immunity, 亦即Th1-type immunity)會受到抑制,但是體液免疫(humoral immunity, 亦即Th2-type immunity)會增強;Shafer-Weaver et al. (1999)的研究也證實牛隻在轉換期,CD4+ T-淋巴細胞優先的產生Th2細胞激素【間白素-4(interleukin-4, IL-4)和間白素-10(IL-10)】,到了泌乳的中後期則轉向產生Th1細胞激素【干擾素-γ(interferon-γ, IFN-γ)和間白素-2(IL-2)】,也意味著Th1免疫反應在轉換期受到抑制,這個現象不僅增加轉換期牛隻感染疾病的機會,也必然會影響牛隻對疫苗注射的反應(Shafer-Weaver, et al., 1999)。美國動物疾病研究中心一項未發表的研究(Kehrli, 2001.引用Nonnecke & kimura, 未發表資料)也顯示牛隻在轉換期,免疫系統所產生的干擾素-γ明顯的減少(【圖三】)。
|
|
【圖三】轉換期牛隻的淋巴球在試管中干擾素-γ |
|
距離分娩的天數 |
|
影響轉換期牛隻免疫功能的因素 |
|
|
《懷孕與分娩過程》 |
|
|
牛隻在分娩的過程體內的內泌素激烈的變化,這些內泌素的變化也是免疫機能受抑制的因素之ㄧ(Kehrli, 2001)。在老鼠的試驗中,動情素和助孕素扮演了抑制細胞免疫和促進體液免疫的角色,轉換期牛隻的動情素和助孕素激烈的變化也可能是牛隻在這段期間免疫系統功能不佳的因素。分娩的過程對牛隻而言是非常嚴重的緊迫,在緊迫的情況下,皮質類固醇(corticosteroids)的產量激增,皮質類固醇(包括常用的消炎用藥-人工合成的dexamethasone)都會抑制免疫系統的機能;Nonnecke et al., (1997)證實dexamethasone會改變不同淋巴細胞的族群比例,分泌干擾素-γ和免疫球蛋白M的細胞在施打人工合成的dexamethasone後明顯的減少(Nonnecke, et al., 1997);所以皮質類固醇也是抑制牛隻轉換期免疫系統的元兇。因此,只要是緊迫,不論是環境(Bernabucci, et al., 2002)、人為管理、營養不平衡所造成的,都會引起皮質類固醇的增加,造成免疫機能的下降。在轉換期影響免疫機能的另一個因素是鴉片?類(opioid peptides)內泌素濃度的改變(Kehrli, 2001),鴉片?類內泌素包括β-腦內啡(β-endorphin)和腦素(enkephalins);鴉片?的血中濃度在空胎和懷孕前期一直都很低,一直到懷孕期的最後一個月,β-腦內啡的濃度才逐漸升高,這些鴉片?的濃度在分娩時達到最高,一直到產後48小時才又降低至正常濃度;在牛隻接近分娩時腦素的血中濃度急速上升,一般認為其作用在降低牛隻感知分娩過程的疼痛,因此經歷難產的牛隻產後β-腦內啡濃度顯著的高於正常分娩的牛隻,也難怪難產的牛隻遭受感染的機會明顯較高。 |
|
|
《泌 乳》 |
|
|
牛隻泌乳需要耗用大量的營養分,內泌素也產生激烈的變化。為釐清單純因為泌乳對代謝和免疫功能的影響,美國農部位於Ames, IA的國家動物疾病研究中心進行了一系列懷孕牛乳房切除手術的研究,將同一時段即將分娩的牛隻部份進行乳房切除手術成為「少奶奶」,另一部份留為對照組;測定所有懷孕牛分娩前後各項代謝與免疫機能的指標,因為所有牛隻都經歷了懷孕和分娩的過程,但是乳房切除牛隻沒有蓄積初乳和後續的泌乳動作,所以對照組牛隻和乳房切除組牛隻之間的差異就單純是泌乳對這些性狀的影響。 |
|
|
首先我們先來看看乳房切除對營養代謝和內泌素的影響(Goff, et al., 2002)。乳房切除牛隻和對照組一樣也有分娩前乾物質採食量下降的現象,但是在整個轉換期,乳房切除牛隻的?物質採食量都比較低,可能是營養需求量較少的結果,因為乳房切除後,牛隻減少了維持和更新乳房組織的營養需求,也沒有積聚初乳和分娩後的泌乳需求,因此採食量的降低是相當合理的。乳房切除的牛隻在分娩前後也有動情素和皮質類固醇上升的現象,可見分娩過程的內泌素變化對所有牛隻的影響是相同的。一般牛隻在分娩時會出現血中鈣、磷、維生素E(α-tocopherol)和β-葫蘿蔔素(β-carotene)下降的現象;乳房切除讓牛隻低血鈣的現象完全消失,但對其它營養素的下降趨勢沒有影響,只有緩和下降幅度的現象(Goff, et al., 2002)。乳房切除的牛在分娩時血中游離脂肪酸的濃度也會上升,只是幅度沒有對照組那麼大,在分娩後血中游離脂肪酸回復的時間也較對照組快(Goff, et al., 2002)。 |
|
|
Kimura et al., (1999a)發現分娩時L-選擇素顯著下降,並且在產後迅速的恢復,這個現象並沒有受乳房存在(泌乳)與否所影響;反倒是乳房切除的牛隻在分娩時β2-整合素並未像對照組牛隻ㄧ樣顯著增加。L-選擇素的減少意味著在血管壁滾動游移的嗜中性白血球數量減少,因此不論是否泌乳,分娩的過程免疫機能下降是無可避免的;因此β2-整合素的增加也就不具任何意義。乳房切除組和對照組的牛隻在分娩時嗜中性白血球的myeloperoxidase活性都會顯著的降低,但是乳房切除(不泌乳)的牛在產後恢復的速度較快(【圖二】)。在淋巴球方面,乳房切除可以移除分娩時T-細胞族群減少(Kimura, et al., 2002a)和免疫球蛋白G下降(Nonnecke, et al., 2003)的現象。由此可見,分娩過程內泌素的變化才是造成免疫機能受抑制的主要因素,而泌乳所帶來代謝緊迫會讓免疫機能更為惡化,恢復的速度減緩。 |
|
|
《分娩前體態評分 (BCS)》 |
|
|
許多酪農朋友都發現大部分胎距過長而且過度肥胖的懷孕牛在分娩時都狀況百出,不僅代謝疾病的發生率非常高,感染性疾病(乳房炎、子宮炎等)也如影隨形。Bernabucci, et al., (2005)依照牛隻分娩前的體態評分將24頭牛隻分組,有趣的是這些牛隻的體態評分分布在2.0至3.6之間(Bernabucci, et al., 2005),並沒有過度肥胖的現象;這個研究發現牛隻在轉換期都會經歷氧化緊迫(oxidative stress),產前體態評分越高的牛或體態流失越嚴重的牛隻體內所產生的氧化緊迫越大,體內的抗氧化物越少,對氧化緊迫也越敏感;而且氧化狀態和熱能平衡有高度的相關,血中游離脂肪酸和β-HBA越高,體內的氧化物質越多,抗氧化物越少,氧化緊迫也越嚴重。另ㄧ個研究(Lacetera, et al., 2005)將牛隻分成產前體態評分<2.5、2.6至3.5、和>3.5三組,結果發現體態過胖的這一組(平均體態評分接近4.0)在分娩後體態下降的幅度顯著比較瘦的牛隻嚴重,血中游離脂肪酸的濃度也較高,由過胖牛隻血中分離的淋巴球所產生的免疫球蛋白M和干擾素-γ也顯著的少於較瘦的牛隻。由此可見,分娩前體態過胖也是造成免疫機能不佳的原因之ㄧ。 |
|
|
《營養與代謝》 |
|
|
有關轉換期營養與代謝對免疫機能的影響,Goff (2006)做了非常詳盡的文獻查證與探討;因為轉換期免疫系統受抑制最經常造成的臨床性疾病是乳房炎,因此該文主要探討的方向是營養代謝對乳房炎發生率的影響。較早期的流行病學文獻已經證實代謝疾病與乳房炎的發生率高度相關(Goff, 2006);在美國紐約州進行的大族群(2190頭牛)研究證實產後發生乳熱症的牛隻後續感染乳房炎的機會是正常牛的8.1倍;酮病也會讓乳房炎發生率加倍;雙胞胎、難產、蹄病、胎衣滯留也都會增加乳房炎的機率;在瑞典進行的大規模研究也發現胎衣滯留會增加牛隻感染乳房炎的危險性(上述文獻年代較遠,在此不一一列舉)。較近期的研究也證實嗜中性白血球機能下降是導致牛隻發生胎衣滯留的主因,而間白素-8(IL-8)產量的減少是胎衣滯留牛隻嗜中性白血球機能下降的關鍵因素(Kimura, et al., 2002b);所以乳房炎和胎衣滯留可能都是免疫機能受抑制的結果。 |
|
|
1. 熱能負平衡、酮病與脂肪肝 |
|
|
牛隻在轉換期必然會處於一段或長或短的熱能負平衡的期間;當熱能不足時,部份胺基酸會被用於合成葡萄糖,也因此造成蛋白質不足的現象;嚴重的熱能負平衡會導致酮病和脂肪肝。而且嗜中性白血球在對抗感染的過程也消耗大量的熱能,荷蘭牛的成牛體內大約有1.4×1011的嗜中性白血球,其半衰期約6小時(Kehrli, 2001),如果牛隻受感染產生發炎反應,每天大約需要多增加4百萬卡的能量需求(Goff, 2006),對處於熱能負平衡的轉換期牛隻無異於雪上加霜。Goff (2006)認為我們目前對熱能/蛋白質負平衡可能影響免疫機能的認知有限,許多資訊都是由人體或老鼠的研究結果推論而來,而且許多牛隻的試驗也都只在試管試驗中証實。Leslie et al., (2000)則持比較正面的正面的看法,他們所引述的研究摘要認為酮病牛隻的β-HBA濃度足以減少白血球的產量和趨化作用(chemotaxis, 免疫細胞向某種因子單向移動的作用),也會減少細胞激素和免疫球蛋白G的產量;但是對免疫球蛋白M並沒有影響(Goff, 2006);在試管培養基中,高濃度β-HBA也有抑制嗜中性白血球和巨噬細胞吞噬作用和殺菌能力的現象;另ㄧ項研究也證實輕微酮病牛隻的β-HBA濃度(1-2.5mM)有降低嗜中性白血球呼吸爆發代謝的現象(Hoeben et al., 1997)。如果牛隻肝臟三酸甘油脂的含量高於40mg/g(正常值的上限),嗜中性白血球表面的功能性分子(例如:L-selectin)就會減少,細胞的殺傷力和產生氧化合物的能力也下降(Zerbe et al., 2000)。新近的研究証實提供額外的熱能來改善熱能平衡狀態可以有效的提升轉換期牛隻的免疫機能(Stabel, et al., 2003)。 |
|
|
另外一個有趣的試驗(Doherty, et al., 1996)用曾經被肺結核感染的牛隻來測試熱能/蛋白質不足對免疫系統的影響,經過133天長期營養缺乏的牛隻對結核菌素測定的敏感度和正常牛隻並沒有差異,淋巴球和干擾素-γ的產生以及B細胞的數量都沒有差異,只是T-細胞的族群顯著的下降。結核菌素的測定是以改造過的抗原來測定牛隻是否帶有結核菌的抗體,只要曾經被感染的牛應該都會產生抗體,也都會呈現陽性反應,因此營養的好壞並不能改變牛隻對結核菌素測定的敏感性。 |
|
|
2. 低血鈣症 |
|
|
改變細胞內鈣的濃度是許多免疫細胞受體感知變化和調節免疫反應的機制,因此轉換期出現低血鈣的牛隻免疫機能因而受抑制是非常合理的推論。正常的牛隻細胞外的鈣濃度約為細胞內的10000倍,發生乳熱症時細胞外的游離鈣濃度會減少50%,因而減少細胞外鈣穿過細胞膜,使細胞的反應鈍化(Goff, 2006)。但是細胞內外鈣的濃度仍有5000倍的差異,是否真的會對免疫系統有重大的影響?Kimura et al., (2006) 認為轉換期牛隻常見的低血鈣症和免疫系統中單核細胞的細胞內鈣存量下降有相關;該研究的數據證實當免疫細胞接收到活化的訊息時,細胞內鈣存量降低會使釋出離子鈣的作用反應遲鈍,這是造成轉換期牛隻免疫系統受抑制的原因之ㄧ(Kimura, et al., 2006);事實上,周邊血液單核細胞內的鈣存量在分娩前和發生低血鈣症之前已經偏低,因此單核細胞內的鈣存量可能是監控轉換期鈣代謝異常比較敏感的指標(Kimura, et al., 2006)。副甲狀腺素不足也會鈍化脾臟免疫細胞的增殖;此外,低血鈣症也是緊迫的來源,會造成血中皮質類固醇大幅的增加,抑制免疫機能(Goff, 2006)。至於這些免疫機能差異的幅度是否會造成臨床上顯著的不同仍有待證實,因為Kehrli & Goff (1989)刻意以日糧誘導低血鈣症的產生,所有的牛在分娩前後免疫機能都顯著的下降,但是低血鈣和正常血鈣的牛在嗜中性白血球和淋巴球的機能上並沒有顯著的差異。 |
|
|
3. 抗氧化劑 |
|
|
牛隻在轉換期血中抗氧化劑(包括維生素E、β-葫蘿蔔素、和維生素A)顯著減少是不爭的事實,而且切除乳房(只分娩不泌乳)只能緩和但無法完全去除抗氧化劑減少的現象(Goff, et al., 2002)。在90年代有一些文獻探討抗氧化劑對免疫機能的影響,將周邊血液單核細胞和淋巴細胞分離出來在試管中培養,添加維生素E在培養基中並沒有增加免疫球蛋白M和間白素-1的產量(Stabel, et al., 1992),但是由餵飼每天添加1000IU日糧的牛隻取得的細胞在試管試驗中間白素-1的m-RNA表現明顯增加(Stabel, et al., 1992)。荷蘭牛日糧由乾乳至產後八週每天添加1000IU的維生素E,血液、紅血球、和嗜中性白血球的維生素E含量都有增加,但是並沒有減少嗜中性白血球釋出呼吸暴發代謝產物(H2O2和O2-)的量(Hidiroglou, et al., 1997)。維生素A有改善淋巴球機能的作用,而β-葫蘿蔔素似乎只有在乾乳時發揮安定嗜中性白血球和淋巴球機的角色(Tjoelker, et al., 1990);另外的研究證實維生素A對嗜中性白血球的吞噬和殺傷能力沒有影響,β-葫蘿蔔素沒有提升吞噬作用的功能但會增強嗜中性白血球的殺傷能力(Chew, 1993, Daniel, et al., 1991)。在此筆者必須強調,詮釋上述的研究結果需要非常小心,因為前面所提到的這些研究都是體外的試管(in vitro)試驗,而且對免疫機能的改善都只侷限在某一單項,改善幅度是否大到足以影響牛隻在活體商業生產的情況下的表現仍然值得商榷?在加拿大21個商業生產牛場進行的試驗(LeBlanc, et al., 2002)說明了筆者的顧慮,在預產期前一週皮下注射3000IU的維生素E並沒有改善胎衣滯留、臨床性乳房炎、子宮炎、子宮內膜炎、酮病、第四胃異位、和蹄病的發生率(LeBlanc, et al., 2002),只有對原先血中維生素E已經偏低的牛有降低胎衣滯留發生率的效果。為期一年分析20個牧場中1057頭牛的轉換期血液成份結果發現,產前一週血中的維生素E提高1μg/mL,胎衣滯留的危險性減少20%;但是如果游離脂肪酸高於0.5mM時,胎衣滯留的機會增加80%(LeBlanc, et al., 2004);同一研究也證實提高產前血中維生素A濃度可以減少臨床性乳房炎的發生率。筆者相信抗氧化劑對免疫系統有一定程度的幫助,因為它們可以協助保護嗜中性白血球的內膜免於遭受過氧化物的傷害,但是抗氧化劑絕對不是處理免疫相關疾病的萬靈丹,如果外來的病源過多或免疫系統受其它因素的抑制,再多的抗氧化劑也是徒然。因此,最好的策略是依照NRC的推荐量使用,讓牛隻處於不虞匱乏的狀態,隨時?免疫細胞提供修補和保護的功能;至於是否要將轉換期維生素A和E的需求量分別調高為NRC(1989)需求量的150%和500%(Weiss, 1998)則需要更多的研究來證實,從實際應用的角度而言也需要審慎評估其經濟效益。電影「珍珠港」的場景很適合用來形容免疫系統與抗氧化劑的關係,當大量的日軍飛機(病源)入侵時,各式各樣的戰鬥部隊(細胞免疫和體液免疫)才是真正在第一線和侵入者搏鬥的要角,這時候需要的能飛上天空的戰鬥機和拿起槍打落低空掠過敵機的戰士,當然戰士一定會有傷亡,這時候勇敢又美麗的醫護人員(抗氧化劑)就扮演醫治和保護戰士的角色,當入侵的敵人實力遠大於防守部隊(整體的免疫能力)時,臨床性疾病的發生就無可避免;當戰爭延續,只有訓練更多的戰士和製造更多的武器才能改變戰爭的結果,增加醫謢人員當然也不可或缺,但這只是打贏這場戰爭的充分因素,只有強而有力的免疫系統才是充分必要條件。 |
|
|
《遺傳》 |
|
|
隨著生物技術的快速進展,科學家也不斷的在探討牛隻各體免疫機能的差異與控制機制( Burton et al., 2001, Detilleux, et al., 1994, Detilleux, et al., 1995 Kelm, et al., 1997, Kimura, et al., 1999b),以便未來有機會在遺傳選拔和改良上有更積極有效的途徑。這方面的發展離實際應用階段仍有一段距離,我們也需要耐心期待這方面的進展。 |
|
|
《結 論》 |
|
|
牛隻在轉換期發生免疫機能下降的現象是不可避免的。在充分了解影響免疫機能的因素之後,酪農朋友會發現要減少轉換期牛隻感染性疾病最好的方法是減少外來病源的入侵,也就是在環境衛生的控制和感染途徑的阻斷方面要嚴格的執行,然後將基本的畜牧管理做好以降低牛隻在轉換期可能面臨的各項緊迫,緩和免疫系統的負荷,最後才考慮強化免疫系統的可能性和經濟效益,許多增強免疫系統的方法或許都有不同程度的效果,但是其改善幅度如果無法克服其它前述外在因素影響,採用這些方法可能沒有經濟效益。期望透過詳細的文獻查證為轉換期飼養管理尋求更細緻和精準的方法。 |
|
|
參考文獻 |
|
|
Bernabucci, U., B. Ronchi, N. Lacetera, and A. Nardone. 2002. Markers of Oxidative Status in Plasma and Erythrocytes of Transition Dairy Cows during Hot Season. Journal of Dairy Science. 85:2173-2179.Bernabucci, U., B. Ronchi, N. Lacetera, and A. Nardone. 2005. Influence of Body Condition Score on Relationships Between Metabolic Status and Oxidative Stress in Periparturient Dairy Cows. J. Dairy Sci. 88(6):2017-2026. Online. Available: http://jds.fass.org/cgi/content/abstract/88/6/2017. |
|
|
Burton, J.L., P.S.D. Weber, S.A. Madsen, and P.M. Coussens. 2001. Immunogeomics and the periparturient dairy cow: letting leukocytes tell us their own story about disease susceptibility. International Animal Agriculture and Food Science Conference. July 24th – 27th, Indiandpolis, IN. |
|
|
Chew, B. P. 1993. Role of Carotenoids in the Immune Response. J. Dairy Sci. 76(9):2804-2811. Online. Available: http://jds.fass.org/cgi/content/abstract/76/9/2804. |
|
|
Daniel, L. R., B. P. Chew, T. S. Tanaka, and L. W. Tjoelker. 1991. {beta}-Carotene and Vitamin A Effects on Bovine Phagocyte Function In Vitro During the Peripartum Period. J. Dairy Sci. 74(1):124-131. Online. Available: http://jds.fass.org/cgi/content/abstract/74/1/124. |
|
|
Doherty, M.L., H.F. Bassett, P.J. Quinn, W.C. Davis, and M.L. Monaghan. 1995. Effects of Dexamethasone on cell-mediated immune responses in cattle sensitized to Mycobacterium bovis. A. J. Vet. Res. 56:1300-1306. |
|
|
Detilleux, J. C., Kehrli jr, M. E., Stabel, J. R., Freeman, A. E., & Kelley, D. H. 1995. Study of immunological dysfunction in periparturient Holstein cattle selected for high and average milk production. Veterinary Immunology and Immunopathology 44, 251 – 267. |
|
|
Detilleux, J. C., K. J. Koehler, A. E. Freeman, M. E. Kehrli, Jr., and D. H. Kelley. 1994. Immunological Parameters of Periparturient Holstein Cattle: Genetic Variation. J. Dairy Sci. 77(9):2640-2650. Online. Available: http://jds.fass.org/cgi/content/abstract/77/9/2640. |
|
|
Goff, J.P. 2006. Nutritional and Metabolic Effects on Immune Competence of the Periparturient Cow. February 1-2, 2006 Florida Ruminant Nutrition Symposium, Best Western Gateway Grand, Gainesville, FL. |
|
|
Goff, J. P., K. Kimura, and R. L. Horst. 2002. Effect of Mastectomy on Milk Fever, Energy, and Vitamins A, E, and {beta}-Carotene Status at Parturition. J. Dairy Sci. 85(6):1427-1436. Online. Available: http://jds.fass.org/cgi/content/abstract/85/6/1427. |
|
|
Heyneman, R., C. Burvenich, and R Verauteren. 1990. Interaction between the respiratory burst activity of neutrophil leukoytes and experimentally induced Escherichia coli mastitis in cows. J.Dairy Sci. 73:985-994. |
|
|
Hidiroglou, M., T. R. Batra, and X. Zhao. 1997. Bioavailability of Vitamin E Compounds and the Effect of Supplementation on Release of Superoxide and Hydrogen Peroxide by Bovine Neutrophils. J. Dairy Sci. 80(1):187-193. Online. Available: http://jds.fass.org/cgi/content/abstract/80/1/187. |
|
|
Hoeben, D., Heyneman, R., & Burvenich, C. 1997. Elevated level of β-hydroxybutyric acid in periparturient cows and in vitro effect on respiratory burst activity of bovine neutrophils. Veterinary Immunology and Immunopathology 58, 165 – 170.Kehrli, M. E. 2001. Immunological Dysfunction in Periparturient Cows - What Role Does it Play in Postpartum Infectious Diseases? Transition Cow Conference, November 16th -17th. Canandaiua, NY. |
|
|
Kehrli, M.E. Jr. and J.P. Goff. 1989. Periparturient hypocalcemia in cows: effects on peripheral blood neutrophil and lymphocyte function. J. Dairy. Sci. 72:1188-1196. |
|
|
Kehrli, M.E. Jr., B.J. Nonnecke, and J.A. Roth. 1989a. Alternations in bovine lymphocyte function during the periparturient period. Am. J. Vet. Res. 50:215-220. |
|
|
Kehrli, M.E. Jr., B.J. Nonnecke, and J.A. Roth. 1989b. Alternations in bovine neutrophil function during the periparturient period. Am. J. Vet. Res. 50:207-214. |
|
|
Kelm, S. C., J. C. Dettilleux, A. E. Freeman, M. E. Kehrli, Jr., A. B. Dietz, L. K. Fox, J. E. Butler, I. Kasckovics, and D. H. Kelley. 1997. Genetic Association Between Parameters of Innate Immunity and Measures of Mastitis in Periparturient Holstein Cattle. J. Dairy Sci. 80(8):1767-1775. Online. Available: http://jds.fass.org/cgi/content/abstract/80/8/1767. |
|
|
Kimura, K., J. P. Goff, and M. E. Kehrli. 1999a. Effects of the Presence of the Mammary Gland on Expression of Neutrophil Adhension Molecules and Myeloperoxidase Activity in Preiparturient Dairy Cows. Journal of Dairy Science. 82:2385-2392. |
|
|
Kimura, K., J. P. Goff, M. E. Kehrli, Jr., and J. A. Harp. 1999b. Phenotype Analysis of Peripheral Blood Mononuclear Cells in Periparturient Dairy Cows. J. Dairy Sci. 82(2):315-319. Online. Available: http://jds.fass.org/cgi/content/abstract/82/2/315. |
|
|
Kimura, K., J. P. Goff, M. E. Kehrli, Jr., J. A. Harp, and B. J. Nonnecke. 2002a. Effects of Mastectomy on Composition of Peripheral Blood Mononuclear Cell Populations in Periparturient Dairy Cows. J. Dairy Sci. 85(6):1437-1444. Online. Available: http://jds.fass.org/cgi/content/abstract/85/6/1437. |
|
|
Kimura, K., J. P. Goff, M. E. Kehrli, and T. A. Reinhardt. 2002b. Decreased Neutrophil Function as a Cause of Retained Placenta in Dairy Cattle. Journal of Dairy Science. 85:544-550. |
|
|
Kimura, K., T. A. Reinhardt, and J. P. Goff. 2006. Parturition and Hypocalcemia Blunts Calcium Signals in Immune Cells of Dairy Cattle. J. Dairy Sci. 89(7):2588-2595. Online. Available: http://jds.fass.org/cgi/content/abstract/89/7/2588. |
|
|
Lacetera, N., D. Scalia, U. Bernabucci, B. Ronchi, D. Pirazzi, and A. Nardone. 2005. Lymphocyte Functions in Overconditioned Cows Around Parturition. J. Dairy Sci. 88(6):2010-2016. Online. Available: http://jds.fass.org/cgi/content/abstract/88/6/2010. |
|
|
LeBlanc, S. J., T. F. Duffield, K. E. Leslie, K. G. Bateman, J. TenHag, J. S. Walton, and W. H. Johnson. 2002. The Effect of Prepartum Injection of Vitamin E on Health in Transition Dairy Cows. J. Dairy Sci. 85(6):1416-1426. Online. Available: http://jds.fass.org/cgi/content/abstract/85/6/1416. |
|
|
LeBlanc, S. J., T. H. Herdt, W. M. Seymour, T. F. Duffield, and K. E. Leslie. 2004. Peripartum Serum Vitamin E, Retinol, and Beta-Carotene in Dairy Cattle and Their Associations with Disease. J. Dairy Sci. 87(3):609-619. Online. Available: http://jds.fass.org/cgi/content/abstract/87/3/609. |
|
|
Leslie, K.E., T.F. Duffield, Y.H. Schukken, and J. LeBlanc. 2000. The Influence of Negative Energy Balance on Udder Health. Proceedings of National Mastitis Council Regional Meeting. |
|
|
Mallard, B. A., J. C. Dekkers, M. J. Ireland, K. E. Leslie, S. Sharif, C. L. Vankampen, L. Wagter, and B. N. Wilkie. 1998. Alteration in Immune Responsiveness During the Peripartum Period and Its Ramification on Dairy Cow and Calf Health. Journal of Dairy Science. 81:585-595. |
|
|
Mehrzad, J., L. Duchateau, S. Pyorala, and C. Burvenich. 2002. Blood and Milk Neutrophil Chemiluminescence and Viability in Primiparous and Pluriparious Dairy Cows during Late Pregnancy, around Parturition and Early Lactation. J. Dairy Sci. 85:3268-3276. |
|
|
Nonnecke, B. J., J. L. Burton, and M. E. Kehrli, Jr. 1997. Associations Between Function and Composition of Blood Mononuclear Leukocyte Populations from Holstein Bulls Treated with Dexamethasone. J. Dairy Sci. 80(10):2403-2410. Online. Available: http://jds.fass.org/cgi/content/abstract/80/10/2403. |
|
|
Nonnecke, B. J., K. Kimura, J. P. Goff, and M. E. Kehrli, Jr. 2003. Effects of the Mammary Gland on Functional Capacities of Blood Mononuclear Leukocyte Populations from Periparturient Cows. J. Dairy Sci. 86(7):2359-2368. Online. Available: http://jds.fass.org/cgi/content/abstract/86/7/2359. |
|
|
Pappe, M.J., D.D. Bannerman, X. Zhao, and J.-W. Lee. (2003) The bovine neutrophil: structure and function in blood and milk. Vet. Res. 34:597-627. |
|
|
Roitt, I., J. Brostoff, and D. Male. 2001. Immunology. Sixth Edition. Mosby, an imprint of Elsevier Limited. |
|
|
Shafer-Weaver, K. A., C. M. Corl, and L. M. Sordillo. 1999. Shifts in Bovine CD4+ Subpopulations Increase T-helper-2 Compared with T-helper-1 Effector Cells During the Postpartum Period. J. Dairy Sci. 82(8):1696-1706. Online. Available: http://jds.fass.org/cgi/content/abstract/82/8/1696. |
|
|
Shafer-Weaver, K. A., Pighetti, G. M., & Sordillo, L. M. 1996. Diminished mammary gland lymphocyte functions parallel shifts in trafficking patterns during the postpartum period. Proceedings of the Society for Experimental Biology and Medicine 212, 271 – 280. |
|
|
Sordillo, L.M., K. Shafer-Weaver, and D. DeROSA. 1997. Immunobiology of the mammary gland. J. Dairy Sci. 80:1851-1865. |
|
|
Sordillo, L.M. and K.L. Streicher. 2002. Mammary gland immunity and mastitis susceptibility. Journal of Mammary Gland Biology and Neoplsia. 7(2):135-146. |
|
|
Stabel, J. R., J. P. Goff, and K. Kimura. 2003. Effects of Supplemental Energy on Metabolic and Immune Measurements in Periparturient Dairy Cows with Johne's Disease. J. Dairy Sci. 86(11):3527-3535. Online. Available: http://jds.fass.org/cgi/content/abstract/86/11/3527. |
|
|
Stabel, J. R., T. A. Reinhardt, M. A. Stevens, M. E. Kehrli, Jr., and B. J. Nonnecke. 1992. Vitamin E Effects on In Vitro Immunoglobulin M and Interleukin-l{beta} Production and Transcription in Dairy Cattle. J. Dairy Sci. 75(8):2190-2198. Online. Available: http://jds.fass.org/cgi/content/abstract/75/8/2190. |
|
|
Stabel, J. R., Reinhardt, T. A., & Nonnecke, B. J. 1991. Effect of selenium and reducing agents on in vitro immunoglobulin M synthesis by bovine lymphocytes. Journal of Dairy Science 74, 2501 – 2506. |
|
|
Tjoelker, L. W., B. P. Chew, T. S. Tanaka, and L. R. Daniel. 1990. Effect of Dietary Vitamin A and {beta}-Carotene on Polymorphonuclear Leukocyte and Lymphocyte Function in Dairy Cows During the Early Dry Period. J. Dairy Sci. 73(4):1017-1022. Online. Available: http://jds.fass.org/cgi/content/abstract/73/4/1017. |
|
|
Van Kampen, C., & Mallard, B. A. 1997. Effects of peripartum stress and health on circulating bovine lymphocyte subsets. Veterinary Immunology and Immunopathology 59, 79 – 91. |
|
|
Weiss, W.P. 1998. Requirements of Fat-soluble Vitamins for Dairy Cows: A Review. J. Dairy Sci. 81:2493-2501. |
|
|
Zerbe, H., N. Schneider, W. Leibold, T. Wensing, T.A. Kruip and H.J. Schuberth. 2000. Altered functional and immunophenotypical properties of neutrophilic granulocytes in postpartum cows associated with fatty liver. Theriogenology 54:771-786. |
|
|
Zocconi, A., V. Bronzo, R. Piccinini, G. Spreafico, and G. Roffo. 1994. Phagocytic activity of bovine polymorphonuclear leukocytes. J. Dairy Res. 61:27 |
|