 |
|
 |
|
圖 1 |
圖 2 |
圖 3 |
 |
|
|
|
圖 4 |
圖 5 |
|
專題報導 |
應用 CMT 之深思
新竹分所/李素珍
一、 前 言
國內陳等人(1992)合作翻譯「乳房炎還擊-對抗乳房炎的策略」一書,原作者美國 Dr. Philpot 於書中開宗明義說道:「只要養乳牛就會有乳房炎,一牛群潛在性乳房炎發生率約為臨床性乳房炎發生率的 15 倍,若飼養管理良好其比率會降低,因此乳房炎首重預防,如何降低潛在性乳房炎發生率為重點,」。
診測潛在性乳房炎的方法眾多,常用者有:物理性檢查、前擠乳檢查、加里福尼亞乳房炎試驗(California Mastitis Test, CMT)、體細胞數檢測、導電度測定與乳中微生物分離等,每種方法都有優劣點,譬如每頭牛擠乳前進行物理性檢查,可查覺牛隻乳頭或乳房是否有外傷、炎症的徵狀及前擠乳乳汁是否異常,此時操作者的經驗非常重要;有些學者報告,可利用牛乳導電度做為診測乳房炎之指標,但影響牛乳導電度的因素很多,因此要由單一乳樣獲得正確的牛乳導電度是相當不容易;經實驗室分離微生物,可鑑定乳房炎病原菌的種類,並透過抗生素敏感性試驗,輔以適當的抗生素治療得以控制乳房炎,也須相當經驗才得勝任;參加乳牛群性能改良(Dairy Herd Improvement, DHI)計畫之乳牛群每月一次檢測乳質,可獲得個別牛隻體細胞數,供牛群飼養管理改善之依據,然而缺點為當發現某一頭牛體細胞數高時,若未進一步檢查無法得知那個分房有問題,此時可採取分房乳再檢測體細胞數或以 CMT 找出有問題的分房;未參加 DHI 計畫之酪農,就可採用 CMT 供為預防乳房炎利器之ㄧ。然而 CMT 是以肉眼判定結果,人為的主觀因素可能導致判定等級之差異,且無法得知確實的體細胞數為其缺點,且依國外經驗於應用上有許多需注意事項,然而 CMT 具有使用的便利性及低成本,因此國外某些地區仍使用,國內有些酪農也採用,於今年 5 月農委會畜產試驗所主辦的乳房炎訓練班,曾有學員提出一些有關 CMT 的疑問,為避免疏忽某些細節而致誤判,本文即以此為重點,提供酪農朋友應用 CMT 檢測時之參考。
二、加里福尼亞乳房炎試驗(CMT)
|
(一) |
CMT 的檢測原理 |
|
CMT試劑為含 3 % 界面活性劑之鈉鹽或鉀鹽,添加 0.01 % bromcresol purple(BCP)或bromthymol blue(BTB)為指示劑,再調整 pH 為 7.0∼7.5。 |
|
|
當乳腺組織受傷或被病原菌感染時,血液中白血球即大量移轉至乳腺組織。白血球之細胞核含 DNA,而白血球細胞壁主要含大量脂肪,CMT試劑會溶解白血球之細胞壁及細胞核,使細胞核釋出 DNA 與 CMT 試劑作用,依其顏色變化及凝集程度,一般分為陰性、微量反應、1 級、2級及 3 級,級數愈高表示體細胞數愈多,間接地判定乳汁中的體細胞數多寡。 |
|
|
(二) |
操作 CMT 的步驟 |
|
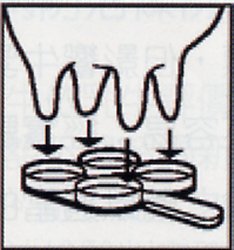
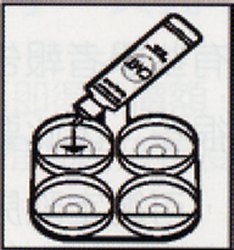
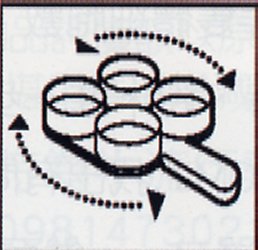
先將乳牛乳頭拭淨,以手將各分房最初第一手乳擠棄,再分別擠入四孔反應盤中(圖 1),將反應盤稍傾斜(圖 2),此時留下之乳量約 2 毫升,各加等量之 CMT 試劑(圖 3),搖動反應盤混合之(圖 4),搖動中約10至15秒內判定(圖 5),此凝集反應於 20 秒後會消失。 |
 |
|
 |
|
圖 1 |
圖 2 |
圖 3 |
 |
|
|
|
圖 4 |
圖 5 |
|
(三) |
CMT反應與乳體細胞數 |
|
依反應的顏色變化及凝集程度,判定為陰性、微量反應、1 級、2 級或 3 級,顏色愈深(深紫色)、凝集程度愈強則判定等級愈高。有關 CMT 的試驗研究非常多,各學者研究報告 CMT 等級所含體細胞數的結果不一,如表 1 所示,突顯CMT以肉眼判定,人為的主觀因素可能導致判定等級之差異,因此建議同一牛群實施 CMT 時,最好由固定人員進行,以減少人為誤差。然而 CMT 等級與體細胞數相關有共同趨勢,即反應等級愈高表示體細胞數愈多,可間接地了解乳汁中的體細胞數多寡。 |
表 1. CMT 等級與乳體細胞數
|
反應結果 |
體細胞數 (mL) |
反應程度 |
|||
|
報告1 |
報告2 |
報告3 |
|||
|
陰 |
- |
<100,000 | <150,000 | <200,000 |
無凝集、牛乳保持 |
|
陽 |
微 量 |
>100,000∼ |
>150,000∼ |
>200,000∼ |
稍微凝集或沉澱,但 |
|
1 |
>300,000∼ |
>400,000∼1,500,000 | 1,200,000 |
明顯凝集,尚未 |
|
|
2 |
2,700,000 |
800,000∼ |
>1,200,000∼ |
凝集程度更強, |
|
|
3 |
8,100,000 |
>5,000,000 |
>5,000,000 |
多量凝集塊,形 |
|
(四)CMT 反應與乳房炎病原菌相關
有許多關於 CMT 反應與乳房炎病原菌相關的研究報告,本文僅舉最近的一篇報告供參考,Ayhan 等人(2008)進行 CMT 檢測並同時取樣分離乳中 6 種乳房炎病原菌,包括無乳鏈球菌(Streptococcus agalactiae)、金黃色葡萄球菌(Staphylococcus aureus)、大腸桿菌(Escherichia coli)、仙人掌桿菌(Bacillus cereus)、格蘭氏陰性葡萄球菌屬(gram negative staphylococci spp.)與格蘭氏陽性葡萄球菌屬(gram-positive staphylococci spp.)等,結果:344 個分房中,有 250 個分房其 CMT 反應呈陽性,94 個分房其 CMT 反應呈陰性,而 CMT 陽性分房中僅 212 個分房被分離出乳房炎病原菌,佔 84.8 %(212/250),而 CMT 陰性分房中有 82 個分房被離出乳房炎病原菌,佔 87.2 %(82/94),研究顯示:CMT 陽性的分房不一定含乳房炎病原菌,然而 CMT 陰性的分房也不代表不含乳房炎病原菌。因此,需定期實施 CMT,並與上次結果做比較,不宜以單一次的結果來判定是否為乳房炎。
CMT 陽性的分房不一定含乳房炎病原菌的原因,可能與欲分離的乳房炎病原菌種類有關。通常分離乳中乳房炎病原菌都以傳染型的無乳鏈球菌及金黃色葡萄球菌為主,然而其他乳房炎病原菌也常被分離出來,譬如:其他傳染型乳房炎病原菌之棒狀桿菌(Corynebacterium bovi)與黴漿菌(Mycoplasma bovis);環境性型乳房炎病原菌除了上述之大腸桿菌外,還有乳房鏈球菌(Streptococcus uberis)、異乳鏈球菌(Streptococcus dysgalactiae)等,及其他乳房炎病原菌,如綠膿桿菌(Pseudomonas aeruginosa)、化膿放線菌(Actinomyces pyogenes)、努卡氏菌屬(Nocardia species)、念珠菌屬(Candida species)、鋸桿菌屬(Serratia species)及巴斯德桿菌屬(Pasteurella species)等。乳房炎病原菌種類眾多,培養時所需的營養、溫度、時間及好氧程度不同,因此,分離乳房炎病原菌需技術及時間。
(五)CMT 反應與乳量之損失
關於 CMT 反應與乳量損失的研究報告眾多,其共同趨勢為 CMT 等級愈高,乳量之損失就愈多。Dr. Philpot 在 1984 年就與美國 DHI 協會(Dairy Herd Improvement Association)合作,研究 CMT 等級與乳體細胞數、乳量之損失,結果:即使 CMT 反應是微量反應,乳量就開始損失,且隨著 CMT 反應等級增加,乳體細胞數愈高,乳量的損失就愈多(表 2)。
表 2. CMT等級與乳體細胞數、乳量損失
|
CMT反應 |
體細胞數(mL) |
乳量損失(%) |
乳量損失(磅)/頭/年* |
乳量損失(公斤)/頭/年* |
|
- |
<300,000 |
3∼7 |
400 |
182 |
|
微量反應 |
300,000∼600,000 |
>7∼10 |
1,000 |
455 |
|
1 |
>600,000∼1,200,000 |
>10∼12 |
1,400 |
636 |
|
2 |
>1,200,000 |
>12 |
>1,700 |
773 |
* 乳量損失:依每年每頭乳量14,000∼15,000磅(6,364∼6,818公斤)計算。
CMT反應:-為陰性;1為有較明顯沉澱或凝集;2為立即明顯凝集。
資料來源:Dairy Herd Improvement Association and Philpot (1984).
(六)CMT 等級與乳中體細胞數及乳成分相關
有關 CMT 與乳中體細胞數及乳成分相關的報告非常多,僅以國內報告為例,李與林(1987)報告乳中體細胞數、乳成分與 CMT 的相關性,結果:CMT 等級與乳中體細胞數、N-乙醯胺基葡萄萄?(N-acetyl-β-D-glucosaminidase, NAGase)酵素活性、氯離子濃度呈正相關,與乳糖呈負相關。顯示:體細胞數、NAGase 酵素活性、氯離子濃度隨 CMT 等級增加而上升,但乳糖卻下降,可供為診測潛在性乳房炎方法之一。當CMT 等級增加時,體細胞數、氯離子濃度與 NAGase 酵素活性都上升,而乳糖量卻下降,會使乳的風味改變,且氯離子濃度高可能影響製造發酵乳製品菌元的活性,影響發酵乳製品製造及產品品質。
(七)CMT 與 DHI 體細胞數相關
目前國內 DHI 計畫每月檢測一次個別牛隻的混合乳,當發現某一頭牛體細胞數高時,若未進一步檢查無法得知那個分房有問題,此時可採取分房乳再檢測體細胞數或以 CMT 找出有問題的分房。
三、CMT 的應用
實施 CMT 的結果只能作為分房是否被感染的參考,建議定期做 CMT,並配合分離乳房炎病原菌後再進行治療,不宜單以 CMT 的結果作為乳牛乳房炎治療或停止治療的依據。CMT 可應用於下列時機。
|
(一) |
可供定期監測乳房健康的參考 |
|
一般建議 2∼4 週定期做一次 CMT,並與前次檢測結果做比較, CMT 陽性反應牛隻宜進行乳樣細菌培養,確知病原菌種類後才進行治療。因傳統分離乳房炎病原菌至少需 1∼2 天,此時應特別注意牧場的消毒工作及擠乳衛生,擠乳時應先擠 CMT 陰性反應的牛隻,而陽性反應的牛隻留到最後擠乳以減少傳播乳房炎的機會。 |
|
|
(二) |
可供乾乳前應用參考 |
|
建議在乾乳期乾乳牛隻要離開泌乳牛群前 10∼14 天再做一次 CMT,陽性反應的牛隻,應立即採樣做細菌分離再進行治療,呈陰性的牛隻,在每天仍有 2 次擠乳時,應再做最後一次 CMT 的監測。目前有些酪農的做法是,於乾乳牛乾乳時所有分房一律注入長效性乳房炎藥膏,這種處理方式的優點是不論分房是否有病原菌都一網打盡,缺點是若分房無病原菌則資源浪費,而此長效性乳房炎藥膏是否對已存在的病原菌有效?若無效可能使病原菌產生抗藥性,導致將來治療的困難度上升。 |
|
|
(三) |
可供乾乳牛治療結果的應用參考 |
|
乾乳前最後一次擠乳時進行 CMT 檢查,與下次分娩正常乳汁(初乳不適合檢查)之 CMT 檢查資料比對,可能有以下4種情況: |
|
|
1. |
乾乳時分房 CMT 陽性反應,再度分娩時為陰性,顯示治療有效。 |
|
2. |
乾乳時分房 CMT 陽性反應,再度分娩時為陽性,顯示 (i) 分房仍被感染治療無效,通常發生在感染金黃色葡萄球菌或黴漿菌。顯示乾乳期間仍持續被感染,乾乳治療的藥物無效,需更改治療的藥物,且再度分娩時這些牛隻需隔離。(ii) 分房於乾乳時治療有效,但在分娩前又被其他病原菌感染。 |
|
3. |
乾乳時分房 CMT 陰性反應,再度分娩時為陽性,顯示乾乳期間或分娩前被感染。若新感染比例很高,可能感染環境型病原菌,以改善環境衛生為優先,需進行細菌培養,確知病原菌種類才治療。 |
|
4. |
乾乳時分房 CMT 陰性反應,再度分娩時也為陰性,顯示未被感染。 |
|
(四) |
可供總乳體細胞數過高時的檢查參考 |
|
若牛群總乳體細胞數過高時,CMT 可以協助找出有問題的牛隻甚至分房,再追蹤檢查。 |
|
|
(五) |
可供分娩後乳汁檢查的參考 |
|
1. |
分娩後乳質正常時(初乳不適合檢查)才做 CMT 檢查,所有陽性分房應分離是否含乳房炎病原菌,若是傳染型病原菌則需隔離並最後擠乳,待確認無傳染型乳病原菌或檢查體細胞數或 CMT 反應陰性,確認正常後才混入泌乳牛群。 |
|
2. |
CMT 陽性反應之新分娩牛,每週一次 CMT 追蹤檢查,可了解其感染的變化。若 2 週後 CMT 檢查陽性,但未分離出一般常見的傳染型乳房炎病原菌,仍需認為已被感染,這些牛隻可以 CMT 追蹤檢查及分離是否含其他乳房炎病原菌。 |
|
3. |
新分娩牛發生至少一個分房CMT陽性反應,且分離出環境型病原菌時的處置:每週或每 2 週進行 CMT 檢查,約 50 % 環境型病原菌感染之新分娩牛會自發性痊癒,且 15∼30 天內消失。若分娩後 14∼21 天 CMT 反應與分娩後第一次 CMT 反應比較,分房陽性率上升,擠乳時就須留意擠乳衛生及擠乳前藥浴乳頭,必要時以藥物治療。 |
|
(六) |
可供新購牛隻混入泌乳牛群的檢查參考 |
|
新購之泌乳牛隻尚未分離乳房炎病原菌或檢查體細胞數時,需隔離並於擠乳時最後擠乳,當完成分離乳房炎病原菌或檢查體細胞數(包括 CMT),確認正常後才混入泌乳牛群。 |
|
|
四、應用 CMT 的注意事項 |
|
|
(一) |
為獲得標準化的 CMT 作業,需留意以下事項: |
|
1. |
操作 CMT 前,先將乳牛乳頭拭淨,各分房最初第一手乳要先擠棄(不用)。 |
|
2. |
接下來將「前擠乳」擠於 CMT 四孔反應盤中,將反應盤稍傾斜,留下約 2 毫升乳量。 |
|
3. |
各加入與前擠乳等量之 CMT 試劑,不可過量。 |
|
4. |
緩慢搖動,使前擠乳與 CMT 試劑混合作用。 |
|
5. |
在視線良好的位置,搖動四孔反應盤並將反應盤稍傾斜,約10至15秒內判定,(若前擠乳與 CMT 試劑混合量超過 4 毫升,為了仔細觀察反應結果,可於搖動混合均勻後,將反應盤稍傾斜,倒掉一些上層液,再仔細觀察)。 |
|
(二) |
實際作業上,建議判定 CMT 反應結果之原則只分為陰性及陽性反應(包括微量反應及 1、2、3 等級),即使是極微量沉澱也要歸於陽性反應,而再細分 1、2、3 等級的陽性反應,也無法獲得更多的資訊,若未處理微量反應的分房,僅處理反應 1、2 或 3 級的分房,可能隱藏了乳房炎。 |
|
(三) |
檢查前擠乳或後擠乳? |
|
一般檢查前擠乳,因後擠乳的體細胞數約為前擠乳的 2∼3 倍。 |
|
|
(四) |
現場檢測或冷藏再檢測? |
|
一般在現場檢測,若採樣冷藏再檢測,需於冷藏 36 小時內檢測完畢,且每回檢測的作業方式要固定(現場檢測或冷藏再檢測),否則易導致誤差。 |
|
|
(五) |
單以 CMT 檢查結果可作為治療乳房炎的依據嗎? |
|
答案是「否」,因為 CMT 檢查僅告知一頭牛 4 個分房中那個分房被感染的機率較高,無法顯示感染了何種病原菌,必須經分離病原菌後再治療,若未分離病原菌而直接治療,可能耗時、耗成本且可能導致產生抗生素敏感菌株。 |
|
|
(六) |
可能導致 CMT 誤判的原因 |
|
某些因素會使乳體細胞數上升,致 CMT 呈陽性反應而誤判。如:藥物治療後 1∼2 週、初乳或乾乳末期、乳房或乳頭端受傷、發情、其他疾病(如腐蹄、子宮發炎等)、擠乳機真空壓不穩定等。 |
|
|
(七) |
影響 CMT 試劑的因子 |
|
製作 CMT 試劑的水質及其濃度、pH 值對 CMT 判定非常重要,國內家畜衛生單位配置 CMT 試劑,提供酪農使用已行之多年。目前國內有廠商引進商品化之 CMT 濃縮試劑,須依其說明將濃縮之 CMT 試劑以蒸餾水或優質軟化水稀釋,稀釋後之試劑需呈紫色才得使用。並密閉、貯存於陰暗乾燥處,或冷藏儘速使用完畢。 |
|
五、結 語
國內自 1999 年 6 月將牛乳體細胞數納入生乳計價,當年 6 至 12 月酪農總乳之體細胞數每毫升平均 40 萬,逐年下降至 2005 年的 24 萬。國內酪農水準相當高,對於提升生乳品質不遺餘力以降低牛群乳房炎發生率才有此成果。實際上乳牛群難免會發生乳房炎,而體細胞數高的牛乳可能都未納入總乳中,這些高體細胞數的牛乳無法交乳都是酪農的損失。目前國內參加 DHI 測乳計畫的酪農戶約佔 40 %,未參與 DHI 計畫的酪農戶就可善用 CMT,定期追蹤比較其檢測結果,及早發現有問題的牛隻,妥善處理以減少損失。
參考文獻:
|
1. |
李素珍、林慶文。1987。乳牛生乳中體細胞數、乳成分與加里福尼亞乳房炎試驗的相關性。科學農業35: 154-156。 |
|
2. |
陳煥南、李素珍、毛嘉洪、徐慶霖合譯。1992。乳房炎還擊-對抗乳房炎的策略。台灣區雜糧基金會發行。 |
|
3. |
Ayhan B., K. Cihan, B. A. Duygu, S. Mithat and C. Mehmet. 2008. Investigation of the incidence and diagnosis of subclinical mastitis in early lactation period cows. Turk. J. Vet. Anim. Sci. 32 (2): 119-121. |