|
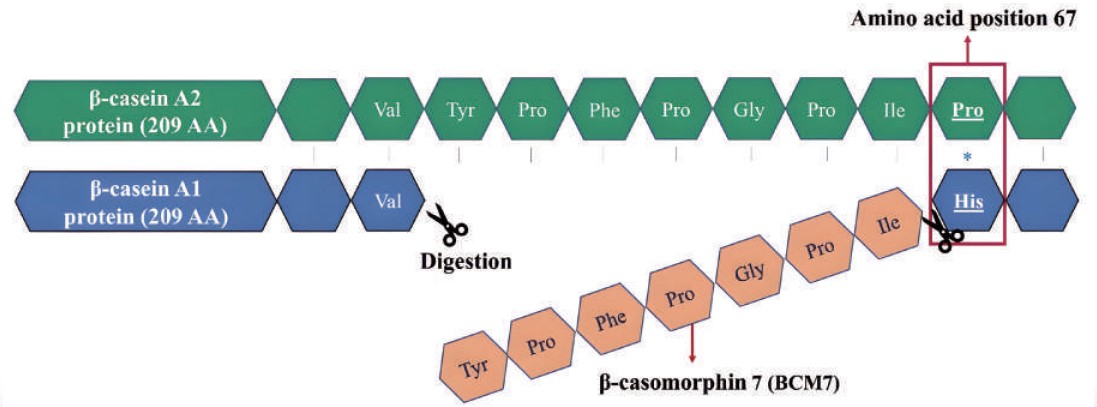
一、前言 酪蛋白具有多種基因型,包含αS1-, αs2-, β 及κ-casein,多種酪蛋白約占牛乳中80%的蛋白質。在多種的酪蛋白中,以A1β及A2β酪蛋白比例為最高。A1β在第67號位點的蛋白質是由組胺酸(Histidine)所構成,經酵素分解後會產生β- 酪啡肽(β-casomorphin 7, BCM-7),造成胃腸道不良反應,另有文獻指出BCM-7與第一型糖尿病、心血管疾病與神經系統有關(Saba et al., 2022)。 而A2β酪蛋白因第67位點的胺基酸為脯胺酸(Proline),與A1β不同,因此經胃腸道消化後,不會釋放BCM-7,因此A2β不會對人體造成前述消化不適的問題。因此,開始有許多乳品廠研發並推廣A2β產品。為了避免摻假及誤導消費者,發展出快速檢測牛乳中酪蛋白基因型的方法是必要的。因此,本文將介紹三種檢測酪蛋白基因型的方法並分析三種方法之特性。
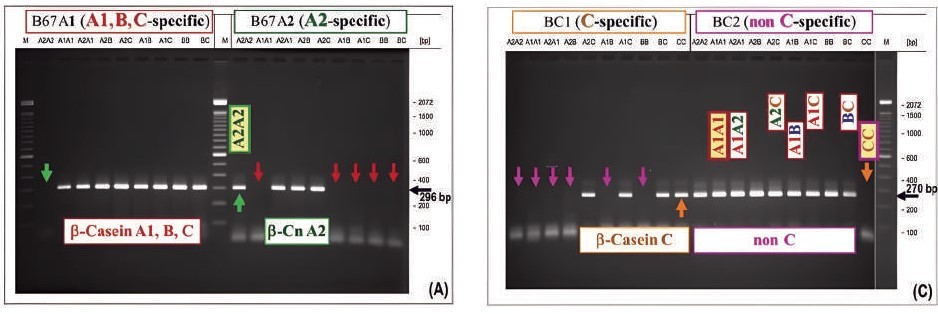
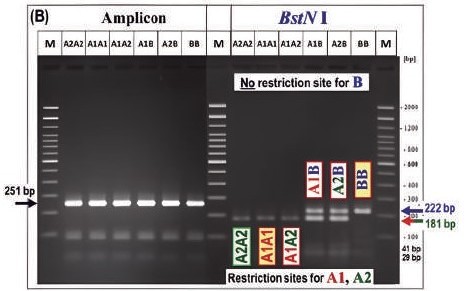
二、聚合酶連鎖反應(Polymerase chain reaction, PCR) PCR是利用DNA雙股片段,透過短時間大量擴增目標基因序列的方法。其中PCR又包含等位基因特異性PCR(allele-specific polymerase chain reaction-PCR, AS-PCR)、增幅限制酶切位點(artificially created restriction site-PCR, ACRS-PCR)與限制酶片段長度多型性(restriction fragment length polymorphism-PCR, RFLP-PCR)。三種的原理相似,皆利用具有特異性的DNA序列設計引子,進行擴增後產生PCR產物而限制酶的作用機制則是透過DNA的多型性造成切位點與DNA長度發生改變,再透過電泳區別其基因型。 在測定過程,PCR較為繁雜。首先,進行PCR之前須進行DNA的萃取,且需準備正確的DNA序列以製作精確度高的引子。進行PCR的溫度與時間的設定都需要經過考量。最後,在限制酶截切的部分,則需另外準備多種酵素,如Taq I BstNI與Dde I等以區別不同的基因型。在Mayer等人(2021)的研究指出,透過PCR可以區別A1β及A2β,甚至是占比較低的B型與C型酪蛋白都可以區別(圖二及三)。 因此,PCR可以準確地檢測A2β乳中是否受到A1β的汙染,但是PCR污染的程度,即A1β的含量,則是無法透過PCR檢測得出。
三、酵素結合免疫吸附分析法(Enzyme-linked immunosorbent assay, ELISA) 第二種介紹的檢測方法為ELISA。ELISA是透過抗原與抗體之間的專一結合特性,並且搭配呈色劑產生螢光進行檢測的一種方法。 在收到檢測樣品時,首先要製備符合標準的標準曲線(standard curve),並且將乳品進行稀釋以利測定。Yayla(2023)指出,ELISA測試牛乳中A1β與 A2β檢測極限分別為1.8 ppm與0.8 ppm,定量極限為17 ppm與2.4 ppm。在重複性變異測定上,A1β與A2β的變異性分別為10.3%與2.9%。 由上述可知,利用ELISA不僅可以分析牛乳中A1β與A2β的有無,透過吸光值測定,亦可準確地計算得知乳中A1β與A2β的含量,可判斷A2β牛乳是否受到A1β的汙染。然而,ELISA測定樣品所需的時間較長,常常需要4-5小時的操作時間,且因ELISA需要酵素免疫分析儀的檢測,因此無法在現場進行操作。
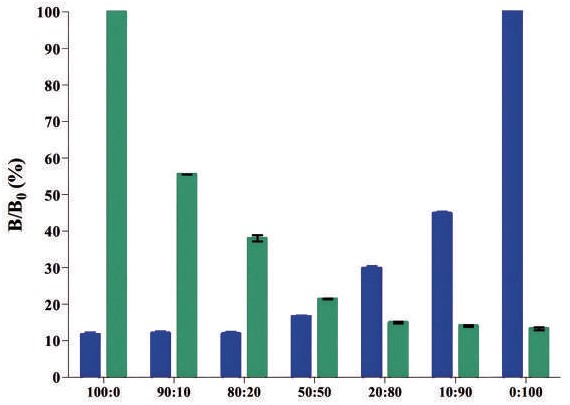
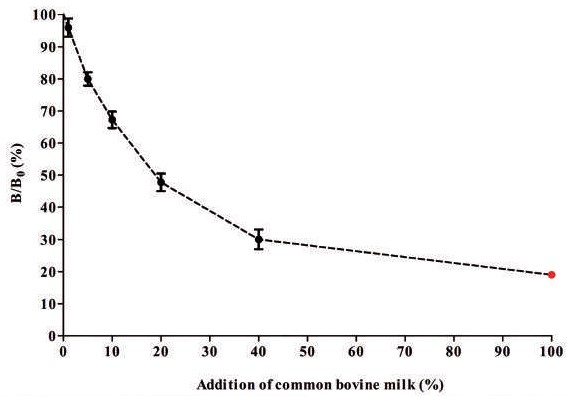
四、化學冷光微粒免疫分析(chemiluminescence microparticle immunoassay, cMIA) 最後介紹的方法為cMIA,透過在抗原/抗體上標記螢光物質或酵素並包覆在微粒的表面,並待其與樣本中的抗體/抗原結合後,經氧化反應使螢光物質呈色,再透過冷光儀進行檢測。在檢測A1β與A2β的微粒具有磁性,微粒外層具有羧基會與A1β或A2β結合產生螢光。 樣品的處理與ELISA相似,需先將牛乳進行稀釋。於稀釋後的牛乳中添加β-酪蛋白特異性微粒與抗體,經培養後微粒會與磁珠結合。接著加入螢光標記物R-Phycoerythrin 即可測定其螢光強度(Median Fluorescent Intensity, MFI)的訊號,整個測定時間所需的時間約2小時。這種測定方法屬於競爭型,即β-酪蛋白含量越高時,MFI訊號會越弱。此現象在Elferink等人(2022)的研究中顯示,B/B0為抗體的結合百分比,當於 A2β牛乳中添加β-酪蛋白微粒時,A1β的B/B0為100%,而A2β的B/B0為0%;反之亦然,當於A1β牛乳中添加β-酪蛋白微粒時,A1β的B/B0為0%,而A2β的B/B0為100%;而當測定A1A2β牛乳時,則兩者的B/B0皆趨於0%,且具有劑量效應(圖四)。因此,cMIA可以針對乳中的AI與A2β進行半定量,了解其中添加的比例。 除了可以檢測A1β與A2β的比例之外,cMIA亦可檢測其他物種的乳品是否經過參假。同樣在Elferink等人(2022)的實驗指出,當添加一定比例的A1A2β進入其他物種的乳品中,其MFI也會逐漸降低,當A1A2β牛乳添加量達20%時,其B/B0會降低約50%(圖五)。因此,A2β牛乳的摻假亦可透過cMIA方法進行檢測,最低可檢測至1% 的A1β牛乳添加量。 因此由上述可知,cMIA是一種具有敏感度且準確度高的一種測試方法,但同時其設備需求高,需要額外測定螢光的冷光儀,因此成本也相對較高。
五、結論 A1β會釋出BCM-7,可能與心血管疾病、第一型糖尿病與神經疾病等問題有關而A2β則沒有上述的疾病誘發可能性。因此,若能使用合適的工具分析個體的基因型或乳中的酪蛋白基因型與含量將會是未來的趨勢。如表一所示,目前已有許多方法不僅可以檢測牛乳中酪蛋白的基因型、了解A1β與A2β的比例與含量,甚至不同品種的動物的生乳是否經牛乳的摻假皆可檢驗得知。雖然目前台灣並未針對牛乳中A2β純度進行規範,但若能透過這些方法明確地檢測出牛乳中的酪蛋白比例,可以讓消費者更透明且更自由的選擇飲用的產品。
五、參考文獻
| ||||||||||||||||||||||||||||||||||||||||||||||||