 |
 |
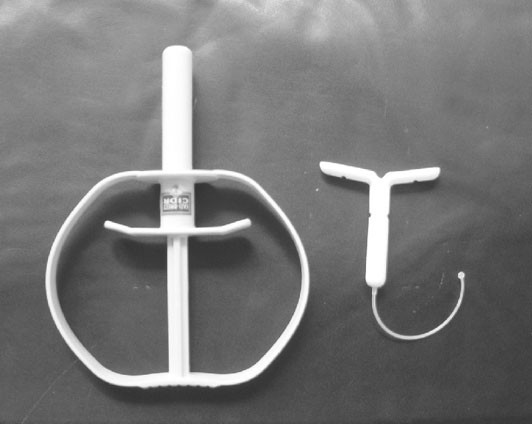
| 圖一、母羊發情同期化使用之陰道內助孕素釋放器CIDR(左)及自製之替代品泡棉與矽膠柱(右) | |
山羊生殖技術之研發
行政院農業委員會畜產試驗所恒春分所 黃政齊 分所長
一、前言
山羊是國內重要的畜產業之一,然而,受到政府早期被動養羊政策之影響,山羊產業之研究與發展起步甚晚,畜產試驗所恆春分所為國內最主要之養羊研究中心,遲至民國70年代才開始陸續引進努比亞、撒能及阿爾拜因等山羊,進行肉羊與乳羊之相關研究。
生殖效率之高低為影響養羊場經營成敗之重要指標之一。應用輔助性生殖科技(assisted reproductive technology),除了能有效改善羊群的生殖管理與生殖效率之外,更進一步能加速羊群的遺傳改良與種原更新,是國內養羊產業降低生產成本及提升競爭力,必要採行之科學化技術。恆春分所在過去20年來,陸續進行各項輔助性生殖技術之研發與推廣應用,為山羊相關研究中,比較有系統與成果的項目之一。
二、繁殖季節人工調節技術之研發與應用
山羊是屬於短日照發情的家畜,溫帶地區羊隻以8月至隔年2月為繁殖季節,而以春季為深度乏情季節。台灣地處亞熱帶,據黃等(1993)之調查,南部及東部地區的羊隻雖無深度乏情(deep anestrus)現象,然而在春季仍有不同程度的乏情現象發生。秋冬兩季是羊乳的消費旺季,也是生乳價格較高的季節。然而,受到母羊春季乏情的影響,多數母羊無法在秋季分娩及達到泌乳高峰,不僅降低羊群的繁殖效率,同時也導致羊乳市場的供需失調及降低酪農的羊乳營收,因此羊隻在春季仍需要應用人工技術誘導發情與配種。
在乏情季節中單獨使用公羊效應來誘發母羊發情的效果有限,但公羊效應若搭配其他人工誘發方法,能有效增強誘導發情效果。恆春分所曾比較數種誘發春季乏情母羊發情的方法,結果發現比較適合國內養羊產業使用者包括光照調節及荷爾蒙處理兩種(黃等,1993;黃等,1995;黃與溫,1997;黃與楊,1999;吳與孔,2005)。
(一)光照調節法
光照調節法是模仿夏、秋兩季的自然光照長短變化模式達到誘導發情的目的。光照調節所需的時間長達4個月,例如母羊群計畫在五月配種,須自一月開始接受人工光照,方法是在開放式羊舍內,距離床面2.5~3公尺高處裝設日光燈,調整羊隻眼部水平高度的光度在200~250勒克斯(lux)之間,並利用定時裝置,於每天日落前一小時開燈,午夜熄燈4小時,日出之後一小時熄燈,白天則只接受自然光照,使每日光照時間合計達20小時,如此連續2個月之後關閉人工光照,再等2個月之後,將試情公羊放入母羊群中,利用公羊效應的刺激,則大多數母羊可在2週之內發情。為了發揮公羊效應,光照處理期間應將公羊隔離,愈遠愈佳。光照調節法不僅成本較荷爾蒙處理法低廉(黃與楊,1999),且因符合自然法則,母羊在誘導發情之後可持續2~3個動情週期,可增加受孕的機會,也無荷爾蒙處理所引起的副作用。
為了確保種公羊在春季仍能維持旺盛的配種能力,種公羊也須一併接受光照處理。法國進行連續3年的實驗證實,種公羊每2個月輪流一次接受長光照(16L:8D)與短光照(8L:16D)的交替處理,精液的品質可完全不受季節的影響。
(二)荷爾蒙處理法
荷爾蒙處理的方法是採用含有助孕素的矽膠(如CIDR , 含366mg progesterone)或自製泡棉(含45mg FGA)或矽膠埋植物(圖一)等助孕素釋放器(黃與林,1998),塞入母羊陰道內或埋植於皮下並留置11天,但在第9天,也就是取出陰道塞劑或埋植物之前的48小時,每頭母羊肌肉注射500單位馬絨毛膜激性腺素(eCG,舊稱PMSG)及100μg cloprostenol (前列腺素PGF2α衍生物,Estrumate )。eCG的注射劑量,在女羊可減為400單位,高產泌乳羊則須增至600單位。母羊約在去除外原性助孕素之後24小時左右發情。自製泡棉助孕素釋放器在卵巢切除母羊體內之助孕素釋放與誘導母羊發情效果與市售CIDR並無差異,但價格卻顯著降低(黃與林,1998)。此一方法的優點包括(1)相較於光照處理省時(2)有效:90%以上母羊能被誘發發情,受胎率達85%以上 (3)發情集中,方便人工授精之實施(4)可提高產仔數,平均每胎達2.2頭(黃等,1993;黃與溫,1997)。缺點包括(1)可能產生eCG抗體,影響後續eCG處理效果(黃等,2001)(2)每年只允許處理一次(3)乏情季節只能誘發一次發情配種機會(4)母羊自塞劑拔除至發情開始的間隔,與該母羊一生中曾接受eCG處理的次數成正比,受胎率也可能因處理次數增加而降低。
褪黑激素(melatonin)也曾經以皮下埋植或口服方式,單獨或配合光照處理及公羊效應被應用於誘發母羊發情(黃等,1993),效果亦可接受,但商業生產之藥物取得不易,因此較少被推廣應用。
 |
 |
| 圖一、母羊發情同期化使用之陰道內助孕素釋放器CIDR(左)及自製之替代品泡棉與矽膠柱(右) | |
三、精液冷藏與冷凍保存技術之改進
(一)新鮮精液採取與稀釋
精液採取的方法包括電氣與假陰道兩種,電氣採精主要原理是以電激棒透過直腸璧刺激公羊的貯精囊而達到射精之目的,這種強迫性採精方法採得的精液,質量比假陰道採集者為差,一般只使用於不曾接受假陰道採精訓練、神經質、性慾差或因四肢障礙無法適用假陰道採精之公羊。
假陰道法是目前山羊最理想的採精方法。假陰道由內壁有橡皮內襯並可灌入42 ℃溫水的塑膠管、矽膠漏斗及收集精液的離心管等三部分所組成,為了減少精液在體外的溫差變化過大而引起精子的冷休克(cold shock),上述器材在組裝及採精前均需存放於39℃保溫箱中,採精期間假陰道套組必須另以絕緣護套維持適當之溫度。採精前先將發情母羊固定於頸架,於公羊架乘後陰莖插入陰道前之瞬間,將陰莖導入假陰道中射精。假陰道在灌入溫水後可由注水口吹入氣體以增加水壓,並於採精前在其內壁先塗抹對精子無害之凍膏加以潤滑。
採取之新鮮精液於進行外觀性狀、精液量、精子濃度、精子活動力、活精子比例及活精子總量等項目檢測之後,可採用脫脂奶(SKM)或蛋黃Tris果糖(YTF)稀釋液(表一),同溫稀釋至適當濃度之後使用。由於山羊精漿中含有磷酸解酯脢(phosphatidase),作用於脫脂乳稀釋液中可能存在的乳球蛋白及三酸甘油酯,或分解蛋黃素(lethicin)所產生之代謝物質,將降低精子的存活率與活動力,因此在稀釋之前須先遠心分離以去除精漿為宜。稀釋後之精子濃度為每一授精劑量(0.5或0.25mL麥管)中的的活精子數約1億左右,至少也須在5×107以上。稀釋後未立即使用完之精液,須放入同溫之水浴之後,移置於6℃冰箱中保存,新鮮稀釋精液以一天之內用完為原則。於比較SKM及YTF兩種稀釋液對山羊精液冷藏保存之效果,發現YTF優於SKM(黃與章,2002),稀釋液中添加抗氧化劑,對山羊精液之冷藏保存並無顯著之效果。
表一、山羊精液稀釋液之配方
Table1.The composition of diluents for goat semen dilution.
| Components | SKM | YTF |
| Egg yolk (%) | 2.5 | |
| Sodium citrate (g) | ||
| Fructose (g) | 0.5 | |
| Cow skim milk (g) | 10 | |
| Glucose anhydrate (g)n | 0.194 | |
| Tris (tris(hydroxymethyl)aminomethane) (g) | 3.634 | |
| Citric acid monohydrate (g) | 1.99 | |
| Crystalline penicillin (IU/ml) | 50 | 50 |
| Streptomycin sulphate (g/ml) | 50 | 50 |
| Ph-adjusted by citric acid | - | - |
SKM = Cow skimmed–milk diluent; YTF= Egg yolk-tris-fructose diluent.
(二)精液的冷凍與解凍
精液採出後先以Krebs-Ringer-Glucose生理鹽水稀釋成每mL含4億精子濃度,再重複兩次以600g遠心分離15分鐘後,將精漿去除。洗滌過的精子以脫脂奶稀釋液稀釋成每mL含有10億精子之濃度並於水浴中冷卻至4℃,最後再以含14%甘油的脫脂奶稀釋液,在4℃下對等稀釋成每mL含7%甘油及5億精子的稀釋精液,平衡2小時後再分裝入0.25mL麥管,使每支麥管將含有1.25億的精子,最後再利用液態氮之液面蒸氣,約在─80℃左右3~5分鐘,之後直接投入液態氮中,以快速降溫方法進行冷凍(黃等,1997),並於液態氮(-196℃)桶內長期保存。
冷凍精液之解凍時,將自液態氮桶中取出之麥管,直接投入36℃溫水中解凍30秒即可。
四、山羊人工授精技術之推廣
人工授精的器材包括附有光源的陰道開張器、精液解凍器、麥管護套、人工授精槍及潤滑用凍膏等。採用陰道內助孕素釋放器(CIDR)併用PGF2α及eCG的方法發情同期化的母羊,在CIDR取出後16小時開始,每隔3個小時偵測發情一次,母羊可在發情後22小時,或在CIDR取出後43小時,進行一次人工授精。由液態氮桶中取出的冷凍精液,先在36℃的溫水中解凍約30秒後,擦乾麥管、剪開封口端、裝入護套,再與授精槍組裝後備用。授精時,母羊須先以頸架固定之後,以助手或自行研發之油壓配種架,將其臀部抬高至接近90度角,再利用陰道開張器及照明燈的使用,找尋子宮頸口的位置後,將授精槍對準子宮頸口緩慢插入,於通過子宮頸之後將精液緩緩注入子宮體內。子宮頸長約3.8公分,內部有3~5道的皺壁,只有約20%發情母羊的子宮頸允許授精槍順利的通過,其他大部分授精槍無法輕易通過子宮頸的母羊,則不可勉強施力,只須將精液注入子宮頸內授精槍可達之位置即可。
國內山羊人工授精之發展早期,所獲得之受胎率偏低(黃等,1995),主要的原因包括:進口冷凍精液之來源複雜品質不穩、授精適期之精確度不足及在授精地點要求深入至子宮體之情況下,往往造成生殖道之損傷,效果適得其反。近年來,在法國人工授精中心(CAPRI-IA)之協助下,雖然受胎率有明顯之改善(吳與孔,2005),惟在各養羊場間受胎率仍有極大之差距,仍有待建立標準化之授精條件。過去多年來,在農委之補助計畫下,由中華民國養羊協會與畜試所恒春分所共同推動民間乳羊場之人工授精計畫,目前仍持續進行中,使用包括恆春分所自製及自美、法等國進口之冷凍精液。
五、山羊胚冷凍保存技術之研發
自從1980年代至今,動物胚在傳統上一直都是採用電腦程式降溫的冷凍器,以慢速降溫方式進行冷凍保存。應用此一技術所採用之冷凍保護劑為1.5 ~1.8 M 乙二醇(ethylene glycol, EG )(Martinez and Matkovic, 1998)。回收之可移置胚,在冷凍前分別於含0.5M、1.0M 及1.5M EG之培養液(PBS)中進行短暫培養,最後裝載於0.25 mL之麥管中,由室溫20℃開始,每分鐘降4℃,至-7℃,植冰(seeding),並在-7℃保持10分鐘,之後以每分鐘0.3℃降至-30℃,保持15分鐘後再投入液態氮(黃等,1997; Cognie et al., 2003)。慢速降溫的冷凍技術需要昂貴的設備與時間的耗費,並不適合在田間使用,且在冷凍過程中,細胞內、外的水會產生冰晶,導致溶液中水分與溶質的分離,因而提高溶質濃度產生溶質效應,對於細胞的傷害包括滲透壓及冷卻的傷害、透明帶與胚細胞的破裂,以及細胞骨架的破壞等等(Liebermann et al., 2002),影響解凍後胚之存活率。
為了改善傳統冷凍技術的缺點,過去有許多研究,都致力於發展簡便有效之替代技術,其中一種超急速冷凍,稱之為玻璃化(vitrification) 的冷凍技術即應運而生。早在1985年,即開始有小鼠胚嘗試採用玻璃化技術冷凍保存的報告提出(Rall and Fahy, 1985)。8年之後,試驗證實小鼠胚確實可以成功的以玻璃化冷凍技術保存(Ali and Shelton, 1993)。1996年Martino等初次成功的採用玻璃化方法保存牛的卵母細胞,並在解凍之後能受精發育到囊胚階段。1997年由於開放式拉製麥管(open-pulled straw, OPS)的研發,取代了傳統0.25 mL麥管,大幅提高降溫速率,體外生產的牛胚得以成功的以玻璃化冷凍保存(Vajta et al., 1997)。到了1999至2000年間,採用玻璃化冷凍的牛及人類卵子陸續成功的懷孕分娩(Kuleshova et al., 1999;Vajta, 2000;Yoon et al., 2000),此後,有關以玻璃化技術成功冷凍保存卵母細胞及胚之報告,即不斷在期刊上被刊載,目前雖已有相當的進展,惟迄今國際上仍缺乏具有商業價值之胚玻璃化冷凍技術可資應用。
含有高濃度冷凍保護劑的溶液在急速冷凍過程中才能產生所謂玻璃化現象,然而,多數冷凍保護劑在高濃度狀態下均具有相當之毒性。因此,決定玻璃化冷凍技術成功率的最關鍵因素是如何提高降溫速率與降低冷凍保護劑的毒性。為了避免冷凍保護劑在冷凍前後對細胞的毒害,須考慮其種類、滲透性、使用濃度及處理時間。在總濃度不變之原則下,採用多元取代單一冷凍保護劑之方式,或胚在玻璃化之前,由低濃度漸進至高濃度分成兩階段處理,且依冷凍保護劑濃度決定處理之時間,均將有助於降低冷凍保護劑之毒性。玻璃化溶液中除了含有冷凍保護劑之外,尚須含有非滲透性物質如蔗醣、海藻醣(trehalose)等雙醣類,或巨分子物質如PVP(polyvinylpyrrolidone)、Ficoll等。
玻璃化冷凍之降溫速率與裝載胚之容器有關,由最早使用0.25mL麥管,至近年改用開放式拉製麥管(OPS)、電子顯微鏡的格網、冷凍線圈(cryoloop)及尼龍篩網(nylon mesh)等,不外是以減少溶液容積及提升降溫速率為主要目的。近兩年來,恆春分所研發免載體之微滴(microdops)玻璃化冷凍器材與技術(圖二),將1~2μL攜帶胚的溶液直接投入液態氮瞬間冷凍,使得降溫速率更進一步提升,因而大幅提高山羊胚冷凍保存之成功率,也使得家畜胚玻璃化冷凍技術商業化應用之可行性大幅提高,目前此一微滴玻璃化冷凍技術,正申請美國專利之中。

圖二、申請專利中的羊胚免載體微滴玻璃化冷凍保存技術
六、山羊胚移置技術之研發與技轉
國內山羊胚移置技術之研發以畜產試驗所恆春分所為主,開始至今已逾15年,最近幾年來,相關技術包括超級排卵、胚沖洗回收及胚移置等,均已先後陸續研發完成,並進一步完成技術移轉至民間產業團體,也接受民間養羊場申請到現場服務,真正將該項技術落實至產業應用層面。
(一)超級排卵技術
例行採用之山羊超級排卵程序如下:供胚母羊以陰道內助孕素釋放器CIDRR (AHI Plastic Molding Co., New Zealand),並在陰道中留置11日,於第9日每頭母羊注射125μg前列腺素cloprostenol (Estrumate, Coopers, Germany),並於第9~11日之間,亦即取出CIDR之前3日,以劑量遞減方式每隔12小時一次,合計6次,肌肉注射總量為16~20 mg之FSH進行超級排卵。待母羊發情後,每隔12小時以同品種公羊進行自然交配一次,至發情結束為止。
影響超級排卵效果之因素眾多,除了動物營養、肥瘦度(Dunn, 1980;Staigmiller et al., 1979 ) 、健康狀態及個體間差異之外,所使用藥物之條件,如種類、來源、劑量及注射方式等亦有所影響。
山羊超級排卵最常使用之藥物為FSH及eCG(舊稱PMSG)兩種,雖然FSH在使用上必須分成6~8次注射,比只須一次注射的eCG不方便,且價格較為昂貴,然而,使用FSH的結果,母羊未排卵的大濾泡數較少(Nowshari, 1992),黃體成熟之前萎縮的情形減少(Armstrong et al., 1983a),此外,適合移置的胚數增加(Armstrong et al., 1983b; Pendleton et al., 1992) ,因此,FSH仍為目前國際上使用最廣的山羊超級排卵藥物。
理論上,使用萃取自同種動物的FSH所獲得的超級排卵效果最好,抗藥性也最低,然而,目前並無商業生產的山羊同源FSH(cFSH)上市,最容易取得的替代藥物為萃取自豬的pFSH,其次為綿羊的oFSH。Baril et al. (1992) 的報告指出,oFSH與pFSH兩者比較,對山羊的超排效果並無差異,但在後續多次重複使用同種藥物進行超排處理時,使用oFSH者,排卵數不至受到處理次數之影響,顯示oFSH在山羊所引起的抗體較pFSH為輕微。
山羊超級排卵曾經使用的pFSH劑量包括15 mg (Armstrong et al., 1983a), 16 mg (Nowshari et al., 1995), 18 mg (Armstrong and Evans, 1984), 20 mg (Pendleton et al., 1986, 1992; Senn and Richardson, 1992) 及 24 mg (Bondioli and Wright, 1981) 等,由於藥物來源及羊隻條件不同,實驗室之間所獲結果難以比較。畜產試驗所恆春分所曾比較兩種劑量之FSH對山羊超排效果之影響,結果顯示16 mg與20 mg之間並無顯著差異(Huang et al., 1999)。
由於FSH的注射方式費時費力,在牛(Takedomi et al., 1993;Yamamoto et al., 1993) 、綿羊 (Dattena et al., 1994) 及山羊goats (Batt et al., 1993) 均曾嘗試採用FSH與PVP (polyvinyl pyrrolidone) 混合一次注射之方式,且獲得與多次注射相同之效果,但並未獲得一致性之結論 (Hsu et al., 1995; Walsh et al., 1993)。
黃體形成素(LH)對於濾泡發育之最後成熟與排卵有其作用,於FSH注射之最後兩針分別併用66μg LH,可獲得更為一致的排卵效果。在恆春分所累積之試驗中發現有部分供胚母羊有黃體成熟前退化(premature regression)之現象。Pintado 等(1998)亦曾發現有高達33%供胚母羊,在超級排卵後第6日發生黃體成熟前退化之現象。黃體早期退化之供胚母羊,多數難以回收到羊胚,即使可自其子宮沖洗出羊胚,胚之品質與發育階段亦多有異常現象(黃等, 2005)。部分學者建議,可考慮提前於配種之後第4日採胚,或於母羊之陰道內使用助孕素塞劑如CIDR (Baril and Cognie, Personal correspondence)。
供胚母羊年齡與身體的成熟度亦影響母畜卵巢對FSH刺激之排卵反應效果 ( Mahmood et al., 1991),經產母羊較女羊所獲得之平均排卵數為高,因此,無論基於母羊生產性能之表現必須在產仔後才能獲得確認而被選做供胚者,或者就胚之平均產量方面考量,在商業化山羊胚移置計劃中,仍以經產母羊做為供胚母羊較為有利。
(二)胚沖洗技術
自供胚母羊體內沖洗與回收羊胚之方法,包括有非外科、腹腔鏡及外科手術等三類,其中所獲得之胚回收效率以外科手術者為最高,其次為腹腔鏡方法,至於非外科法採胚之效率,則遠較其他兩種方法為低,目前已甚少採用。恆春分所早期曾採用半外科方法採集山羊胚,但因出血較多及組織沾黏等問題而停用,目前仍採用腹中線剖腹術採胚。
外科手術採胚之過程中,子宮角自腹腔牽引暴露於體外之後,須分別沖洗兩側子宮角中之羊胚,沖洗之方式不同,操作所耗時間之長短、使用沖洗液量之多寡、胚回收之效率、子宮創傷大小及手術後生殖道發生組織沾黏之程度等亦有差異。法國為山羊人工生殖科技發展最為先進之國家,目前法國國家農業研究院(INRA)與國際上其他大多數實驗室相同,仍一直沿用雙孔式沖胚方法,亦即自子宮角一端之創口將沖洗液灌入,再由另一端創口之導管回收,每一子宮角沖洗液之使用量約50~100 mL,此一沖洗方法之缺點為:(1)增加子宮之創口數。(2)沖洗液用量大。(3)由子宮角之宮管接合處插入回收管,子宮角最末端之羊胚可能無法完全沖出而影響胚回收率。(4)因該處管徑較小,且子宮肌層較薄,若創口在採胚後未經縫合,容易引起子宮內膜外翻與增生,或因組織沾黏而影響母羊後續之生育力。
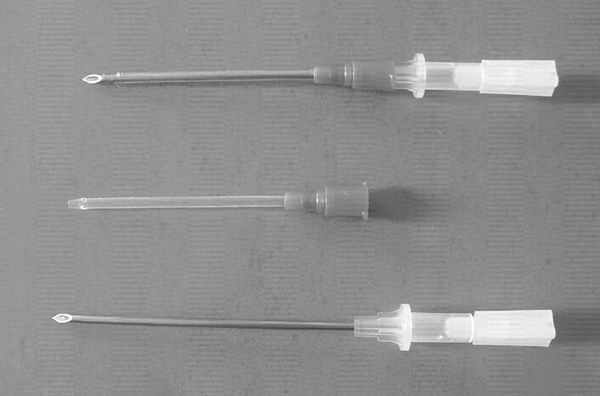
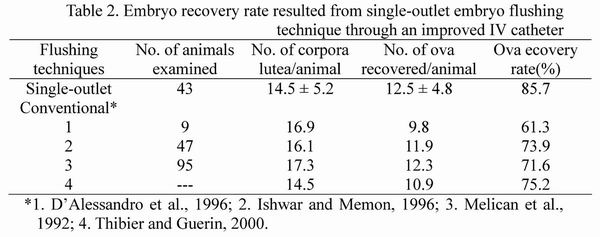
為了改善上述沖洗方式之缺點,恆春分所研發子宮內胚沖洗針與沖洗套組 (圖三)及單孔式沖洗技術(圖四),沖洗針採用鎳鈷合金材質,具有金屬強度高、外徑最小及內徑最大等特性,且採取鈍端設計,於穿刺子宮璧時,對組織之傷害較低,且不易傷及血管造成出血。此外,在沖洗針鈍端附近開鑿相對稱之小孔,對於沖洗液之回收較為順暢,提高沖洗液之回收率。採胚時,於沖洗針之另一端連接矽膠管與注射筒,沖洗針自子宮體端刺入子宮腔內,並於刺入口之近子宮體端以腸鉗阻斷子宮腔,以防止沖洗液流入子宮體,另在宮管接合處以手指捏緊管璧,最後由注射筒注入及回收沖洗液,每一子宮角依羊隻個體子宮大小,每次僅需注入5~10ml沖洗液,每一子宮角僅需沖洗2~3次即可,回收之沖洗液在離心管經短暫靜置後,僅須自底部吸取約1~2 ml之液體供鏡檢即可,操作極為簡便。一般而言,胚之回收率與沖洗液之回收率成正相關,應用此一沖胚器材及單孔式沖胚技術,沖洗液回收率高達98%,胚回收率達85%,亦可減少子宮璧縫合之麻煩及手術後組織沾黏所引起之繁殖障礙。由於商業應用之供胚母羊均為具有高生產性能之超級母羊,避免採胚所引起之繁殖障礙殊為重要。表二所示為採用自行研發之沖洗器材及單孔式羊胚沖洗技術與文獻報告之羊胚回收效率比較,顯示應用自行研發之沖洗器材及沖胚技術,所得之胚回收效率甚高,值得推廣應用。
 |
 |
|
▲圖三、山羊子宮內胚沖洗器材,靜脈留置針(左)及自行研發之鎳鈷合金沖洗針套組(右) |
|
|
|
|
|
▲圖四、單孔與雙孔式山羊胚沖洗示意圖 |
|
表二、應用單孔式羊胚沖洗技術所獲得之胚回收效率
(三)胚移置技術
胚移置入子宮角採用之方法包括腹腔鏡及外科手術兩種。採用外科手術移置之結果發現,每頭母羊於排卵同測之子宮角移置不同胚數(2、3、4個),胚存活至分娩之百分率隨著每頭母羊移置胚數之增加而明顯遞減,每頭母羊移置3個胚者,產羔率高達200%以上(黃等,2002),可達到人工控制生產雙胞胎之目的。然而,每頭母羊移置4個胚,所得之產羔率並未高於移置3個胚者,可能之原因為同時移置過多之胚,在相互競爭之下,反而降低胚之存活率。Warnes等(1982)亦曾指出,每頭受胚母山羊移置胚數高於2個以上時,胚存活率有降低之趨勢。因此,無論就胚存活率或母羊產羔率考量,未來於商業應用時,仍以每頭母羊移置3個胚,可獲得最大之效益。
將胚移入單側或雙側子宮角對母羊受胎率影響之試驗結果,顯示無論是單側或雙側卵巢排卵,僅需將胚移置入受胚母羊之任一與黃體同側的子宮角即可,此乃因山羊胚在著床之前有遷徙之現象(Hafez and Hafez, 2000)。Ishwar and Mimon (1996)指出,在每頭受胚母羊移置2個胚之試驗中,若將2個胚移入同側子宮角,較分別移入異側者有較高之受胎率,原因係在2個胚之間可能產生協同作用(synergism),以增強激黃體(luteotrophic)或抗解黃體(antiluteolytic)效果。激黃體及抗解黃體為反芻動物母體懷孕認知(maternal recognition of pregnancy)之必然現象(Bazer, 1992)。 黃體功能之健全與孕酮之足量分泌對早期羊胚之存活及母體懷孕認知有極大之關聯(黃等,1994;Bazer, 1992)。受胚母羊黃體或排卵數目及其血清中孕酮之濃度,對其接受胚移置後受胎率影響之調查結果,顯示排卵數2個或2個以上之受胚母羊,受胎率顯著較僅有1個者為高,此一趨勢與Warnes et al. (1982)之相關報告相符合,但移入子宮內之羊胚存活率並未受黃體數目的影響。血清中孕酮之濃度亦與黃體數成正比,惟黃體數超過2個以上時,孕酮濃度增加之幅度逐漸降低,因此若以血清孕酮濃度高低預測黃體數並不可靠,然而,供胚及受胚母羊在進行外科手術之前,利用酵素免疫分析法(ELISA)快速測定血清中孕酮濃度,應可提供有無排卵及排卵數是否超過三個以上之參考則迨無疑義。
七、未來發展方向
恆春分所山羊人工生殖科技中心除了延續過去以建立之生殖技術,協助養羊產業提升羊群之生殖效率之外,未來將與法國INRA合作建立山羊胚之體外生產技術,以提供充足的卵與胚材料,以及完善的羊胚早期培養系統,做為後續山羊卵與胚人工操作研究所須之技術平台。此外,亦將加強與畜產試驗所生理組之合作,以細胞核轉置技術產製各種基因轉殖山羊,並合作利用雷射精子分離技術及細胞質內單一精子注射技術,以嘗試山羊選性繁殖之可行性。 本文摘錄自〝畜產試驗所恆春分所百週年慶研討會論文集〞